铁死亡触发波可导致大规模细胞死亡
铁死亡的热度自不必多言, 近期,中研院分生所陈升宏课题组在 Nature 发表了研究,发现铁死亡触发波可导致大规模细胞死亡……
01背景知识:触发波与 FHN 模型
动感光波,biu biu biu?NO!是触发波!!!
多细胞生物有时需要在远距离上快速协调行为。咳咳,说人话……For Example!图片 经历战斗或逃跑反应的人类会在数秒内心率加快、瞳孔扩张、外周血管收缩。但这种情况是无法通过扩散、微管运输、流动等通信方式实现的。
So,触发波,一种反复出现的生物现象,在传播过程中不会减慢或失去振幅,可快速可靠地远距离传输信息。
触发波:举个栗子!
首先,最古老的生物触发波——动作电位。
动作电位起源于轴突小丘 (图 1a) 并以不减的速度和幅度沿轴突传播 (图 1b)。动作电位产生和传播的关键蛋白质是电压敏感的钠通道 (图 1c)。
其电路是一个相互关联的正反馈和负反馈回路系统。反馈回路在蛋白质构象变化和离子流的水平上运行,这两个过程都是非常快速的过程,这使得动作电位的峰值可以在不到 1 毫秒的时间内达到[1]。


图 1. 生物触发波的示例[1]。
(a–c)动作电位。(a) 动作电位在轴突小丘处产生,并沿轴突向远端传播。(b) 通过一系列细胞外电极测量沿轴突传播的动作电位记录。动作电位期间 Na+ 向内流动记录为细胞外电极记录的电位负偏转。(c) 产生动作电位的电路示意图。(d–f) 受精卵中的钙波。(d) 钙波在精子入口处产生并扩散到整个卵子中。(e) 通过钙绿加载后的比率成像测量乳状带虫 Cerebratulus lacteus 母细胞中钙浓度随时间的变化。(f) 产生钙波的电路示意图。(g-i)非洲爪蟾卵中的有丝分裂波。(g)受精和受精后钙波约 1 小时后,Cdk1 激活波从着丝粒附近扩散到细胞皮层。(h)非洲爪蟾卵提取物中的有丝分裂波。薄薄的聚四氟乙烯管中装满了循环的非洲爪蟾卵提取物以及精子染色质和核定位信号--绿色荧光蛋白标记。核膜破裂波从细胞质中最快的区域 (靠近这部分管的中间) 向外扩散。(i)产生细胞周期蛋白 B-Cdk1 激活波的电路示意图。
当然,除了沿神经元轴突传播的动作电位外,典型的例子还包括各种组织中的钙波以及非洲爪蟾卵中的有丝分裂波。
虽然这三种情况下所涉及的蛋白质是互不相关的,但其输出 (膜去极化、细胞内 Ca2+ 或细胞周期蛋白 B-Cdk1 活性) 都会通过触发波在空间和时间中传播。
动作电位:质膜去极化——电压敏感钠通道开放——钠沿着其浓度和电位梯度向内涌入——膜进一步去极化,这构成了一个正反馈回路(图 1C)。动作电位由两个过程终止:电压敏感性钾通道的延迟开放,允许 K+ 流出细胞并恢复细胞内的净负电荷,以及电压依赖性钠通道的自身失活(图 1C)。
钙波:与动作电位一样,钙波是由具有正反馈的电路产生的(图 1F)。在这种情况下,细胞内游离 Ca2+ 的增加激活磷脂酶 C (PLC),后者裂解磷脂酰肌醇 4,5 二磷酸 (PIP 2) 并生成第二信使肌醇三磷酸 (IP 3)。然后,IP 3 与充满钙的内质网 (ER) 上的 IP 3 受体 (IP 3 R) 结合,使 Ca2+ 流入细胞质并进一步激活 PLC(图 1F)。因此,细胞内钙离子的增加会引起细胞内钙离子的进一步增加。此外,细胞内钙离子通过调节内质网中的 IP 3 受体和阿诺定受体(Ryanodine receptor),更直接地刺激内质网钙离子的释放。因此,有两个相互关联的正反馈回路在相似的时间尺度上起作用。细胞内钙离子的增加受到内质网有限容量的限制,然后被膜结合钙泵逆转,构成负反馈回路(图 1F)。
有丝分裂波:产生有丝分裂波的电路如图所示图 1I。该过程以细胞周期蛋白 B-细胞周期蛋白依赖性激酶 1 (Cdk1) 复合物为中心,后者是有丝分裂的主要调节器。蛋白激酶 Cdk1 又受快速、相互关联的正反馈和双负反馈回路调控 (Cdk1 激活其激活剂 Cdc25C 并使其灭活剂 Wee1 失活),从而构成双稳态开关。然后,该开关由时间延迟的负反馈回路关闭;Cdk1 激活 APC/C Cdc20 复合物,这是一种泛素 E3 连接酶,可促进细胞周期蛋白 B 降解并使系统恢复到低 Cdk1 活性状态。
物理助攻:FHN 模型
FitzHugh-Nagumo (FHN) 模型,一组物理学家熟知的方程。FHN 方程最初是作为 Hodgkin-Huxley 动作电位模型的简化提出的,可看作是相互关联的正负反馈回路的简单通用模型,可以产生各种类型的动态响应,包括开关、脉冲和振荡。此外,通过在 FHN 模型中添加扩散,可以产生触发波,这些触发波可快速传播这些开关、脉冲和振荡到很远的距离。
此外,FHN 模型可以表现出三种类型的行为:双稳态 (Bistability)、兴奋性 (Excitability) 和振荡 (Oscillations)。当与扩散等空间耦合机制相结合时,这些响应中的每一个都可以作为触发波传播[1]。
02铁死亡再登 Nature

言归正传!近期,Nature 发表了题为:Emergence of large-scale cell death through ferroptotic trigger waves 的研究论文。该研究证明:铁死亡,一种依赖于铁和脂质过氧化的细胞死亡形式,可以通过活性氧 (ROS) 触发波在人体细胞中以恒定速度(约 5.5 μm/min)长距离传播 (≥ 5 mm),由此引发大规模细胞死亡[2]。
主要内容:
1. 铁死亡可以通过活性氧 (ROS) 触发波在人体细胞中以恒定速度 (约 5.5 μm/ min) 长距离传播 (≥5 mm)。
2. ROS 反馈回路 (Fenton 反应、NADPH 氧化酶信号传导和谷胱甘肽合成) 在控制铁死亡触发波进展中起主要作用。
3. 研究表明,通过抑制胱氨酸吸收引入铁死亡应激可激活这些 ROS 反馈回路,将细胞氧化还原系统从单稳态转变为双稳态,从而使细胞群成为 ROS 传播的双稳态介质。
4. 此外,铁死亡及其传播伴随着胚胎鸟类肢体肌肉重塑过程中大量但空间受限的细胞死亡事件,证实了其在胚胎发生过程中用作组织塑造策略。
本篇文献使用 MCE 产品如下:
RLS-3 铁死亡诱导剂
Staurosporine 铁死亡诱导剂
Trolox ROS 清除剂
铁死亡以触发波的形式传播
研究者使用了 RPE 细胞,其对蓝光照射敏感,并在对年龄相关性视网膜变性期间表现出过度的铁死亡。作者使用 MCE 铁死亡诱导剂如 RSL3 或 Staurosporine 处理后,铁死亡开始并在 RPE 细胞中传播。
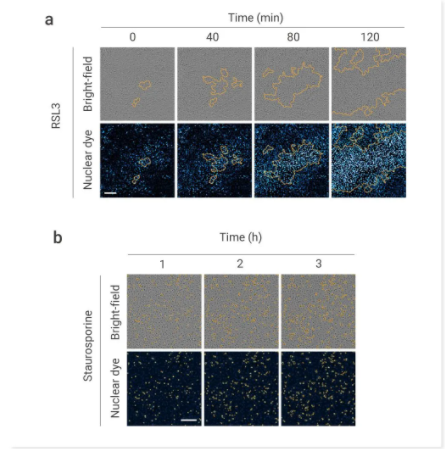
图 2. 铁死亡在不同细胞类型中传播[2]。
RSL3 (0.15 μM) (a) 或 Staurosporine (0.15 μM) (b) 处理的 RPE-1 细胞中细胞死亡的延时图像。显示为明场和核染料荧光图像与细胞死亡轮廓(橙色轮廓)叠加。
蓝光照射会升高细胞 ROS,并促使经 Erastin 处理的 RPE 细胞随后死亡。作者用蓝光照射 Erastin 处理的细胞后,铁死亡从光照区域开始,并以 5.52 ± 0.09 µm/min(平均值 ± 标准差)的恒定速度在 ≥5 mm 的距离内传播。


图 3. 铁死亡通过脂质过氧化前以恒定速度在 RPE-1 细胞中传播[2]。
a-b. 铁死亡从光诱导区域(红色圆圈)开始,并在 18 小时内传播至 5 毫米内经 Erastin 处理的细胞。轮廓(白色轮廓)表示特定时间点细胞死亡的边界。a. 核染料荧光图像(光诱导后 11 小时)与光诱导后 2-18 小时的轮廓叠加。b. 光诱导后细胞死亡的延时图像,显示 a 中橙色框的放大视图。细胞破裂(明场)和核染料荧光增加(青色至白色)表示细胞死亡。c-d:数据来自 a,c:铁死亡传播的延时图像阵列。d:铁死亡传播的动态图。
铁死亡的一个标志是脂质过氧化的升高。作者使用脂质过氧化探针和通用 ROS 探针检测羟基自由基 (•OH)、超氧化物 (O2-) 和过氧化氢 (H2O2-) 均观察到波长 (图中 3a-b),细胞 ROS(•OH、O2- 和 H2O2)波前先于铁死亡传播,且以类似于铁死亡波的速度传播。这表明铁死亡通过触发波而非简单扩散进行传播。此外,作者通过添加 MCE ROS 清除剂 Trolox ,发现其可阻止细胞死亡的传播 (图 4c),这表明多种 ROS 可以共同促进驱动铁死亡传播的信号波前。


图 4. 多种 ROS 可以共同促进驱动铁死亡传播的信号波前[2]。
a-b. 脂质过氧化 (黄色) 和核染料荧光 (青色) 的合并图像。使用 C11-BODIPY 581/591 监测脂质过氧化。黄色轮廓表示特定时间点脂质过氧化的边界。a. 图像 (光诱导后 7 小时) 与光诱导后 1-10 小时的轮廓叠加 (顶部)。底部,图像底部区域量化的细胞死亡和脂质过氧化的荧光强度。b. a 中盒子的放大视图。c. 在光诱导 4 小时后添加 ROS 清除剂如 MCE Trolox (6 µM) 后,Erastin 处理的细胞中细胞死亡传播的动态图 (白色箭头)[2]。
传播机制
ROS 波前的形成需要两个关键要素:(1) 细胞间 ROS 传输的空间耦合机制;(2) 细胞内 ROS 扩增机制 (例如,ROS 双稳态)。作者验证了 ROS 或 ROS 诱导分子的扩散不依赖于细胞与细胞之间的直接接触。且在波停止的情况下,非起始区域边缘的细胞表现出 ROS 积累 (图 5),推测可能是由来自波起始区域的铁死亡细胞的扩散分子引起的。
通过实验,研究者发现这些扩散分子可能是一类 ROS,且不太可能是 H2O2,更可能是过氧化脂质或其副产物。需要进一步研究来确定这些扩散 ROS 分子的身份。


图 5. ROS 信号的扩散作为铁死亡触发波的耦合机制[2]。
a. 在波起始区域 (左) 和非起始区域 (右) 之间产生间隙。细胞死亡 (青色) 和 ROS (黄色) 跨间隙传播的延时图像序列。使用 CellROX 染料监测 Erastin 处理的细胞中的 ROS。在特定时间点沿 2 mm 距离量化 ROS 的平均荧光强度。b. 波穿过不同间隙宽度 (35-380 微米) 的概率。
铁死亡的传播需要细胞间的 ROS 传递和细胞内的 ROS 放大,进而导致它们进一步产生扩散性 ROS 和铁死亡细胞死亡。
至少有三个 ROS 反馈回路可能起作用以扩增铁死亡网络中的 ROS:谷胱甘肽 (GSH) 介导的双负反馈回路和 Fenton 反应 32 和 NADPH 氧化酶 (NOX) 信号传导的两个正反馈回路 (图 6a)。
为了研究这些反馈回路在调节铁死亡传播中的作用,作者通过化学扰动调节了它们的强度 (图 6b)。

图 6. ROS 反馈回路及化学干扰示意图[2]。
a. 铁死亡网络包括三个 ROS 反馈回路。b. 施加化学扰动来调节 Erastin 处理的细胞中 Fenton 和 NOX 反馈回路的强度。
芬顿反应由细胞中游离铁驱动。它将 H2O2 转化为 •OH——一种高活性 ROS,可引发自催化脂质过氧化。使用铁螯合剂去铁胺 (Deferoxamine,DFO) 和铁补充剂柠檬酸铁 (Ferric citrate,FC) 扰乱了铁水平。经 DFO 处理(80 µM)后,我们观察到铁死亡传播速度降低。相比之下,通过 FC 提供游离铁可加速铁死亡传播 (图 7)。

图 7. 化学干扰剂的核染料荧光图像及对铁死亡触发波的影响。
a.核染料荧光图像 (光诱导后 11 h) 与细胞死亡轮廓叠加。黄色轮廓表示添加 DFO (80 µM) 的时间点。b. 核染料荧光图像 (光诱导后 15 h) 与细胞死亡轮廓叠加。黄色轮廓表示添加 FC (250 µM) 的时间点。c-d. 添加铁后,铁死亡触发波的速度增加。c.a 中实验的动态图。d. b 中实验的动态图。波速与DFO (e)、FC (f) 浓度的关系。
NOX 是产生细胞 ROS(O2-和 H2O2)的主要酶类,活性酪氨酸激酶及其下游效应物 (如 PI3K) 可以激活 NOX 以进一步促进 ROS 生成。作者使用 MCE NOX1/NOX4 抑制剂 GKT137831 等三种抑制剂处理 RPE 细胞 (图6b),均减缓了铁死亡的传播 (图 8a-c),并呈现出剂量依赖性 (图 8d-f)。

图 8. MCE NOX1/NOX4 抑制剂 GKT137831 等对铁死亡传播的影响。
a-c. 添加 GKT137831 (1.25 µM)、LY294002 (100 µM) 或 Dasatinib (0.6 µM) 可减缓铁死亡触发波。d-f,波速与 GKT137831、LY294002 和 Dasatinib 浓度的关系。
除了化学干扰外,作者还通过过度表达 ERK2 来基因调节 NOX 信号的强度,铁死亡波在 ERK2 过度表达的细胞中以更高的速度传播,表明 NOX 介导的反馈回路在波传播中起主要作用。
最后,作者建立了一个 ROS 触发波的数学模型,该模型结合了 (1) 铁死亡网络中细胞内在的 ROS 反馈回路;和 (2) 简单扩散作为细胞间的耦合机制。结果表明,Erastin 浓度的增加会导致 ROS 稳态的变化,即从单稳态转换为双稳态。ROS 通常在这种双稳态范围内以触发波的形式传播,进而加速铁死亡传播 (图 9)。

图 9. 铁死亡应激使细胞启动 ROS 双稳态,并促进铁质触发波的传播[2]。
a、计算机模拟显示 ROS 稳态与 erastin 浓度的关系。随着 erastin 浓度的增加,ROS 稳态从单稳态 (低) 分为双稳态 (黄色区域)。稳定的低和高 ROS 稳态和 USS 分别用蓝色、红色和白色圆圈表示。光诱导引起的 ROS 升高 (蓝色箭头,从蓝色圆圈升高到黄色圆圈) 使细胞超过 USS,高于 USS 时 ROS 被放大(红色箭头)到高稳态。b、在不同 Erastin 浓度下光诱导 20 分钟后的 ROS 荧光图像 (黄色)。c. 增加 Erastin 浓度会促进 ROS 波前传播。光诱导 6 小时后用不同浓度 Erastin 处理的细胞群中 ROS 传播的模拟 (顶部) 和实验 (底部)。
此外,该研究揭示了铁死亡传播是一种在发育肢体肌肉重塑过程中消除临时细胞群的机制,证实了其可用作组织塑造研究,在胚胎发育过程中将组织和器官塑造成适当的形状。
参考文献
[1] Gelens L, et al. Spatial trigger waves: positive feedback gets you a long way. Mol Biol Cell. 2014 Nov 5;25(22):3486-93.
[2] Co, H.K.C., et al. Emergence of large-scale cell death through ferroptotic trigger waves. Nature 631, 654–662 (2024).

 2024-09-03
2024-09-03 
 MCE
MCE

