MCE新型 RORγ 反向激动剂XY101
早在 2016 年,中国科学院广州生物医药与健康研究院许永教授团队就曾与加州大学戴维斯分校的陈宏武教授合作,首次发现核激素受体 RORγ 是作用于雄激素受体 AR 上游的关键驱动因子,直接调控雄激素受体 AR 的表达。因此,RORγ 成为前列腺癌治疗的新靶标。2019 年 4 月 9 日,许永教授课题组发现新型 RORγ 受体反向激动剂—XY101,并将该研究成果发表在新药研发知名国际期刊《Journal of Medicinal Chemistry》上。新型小分子化合物的研发过程总是历经千辛万苦,接下来就和小编一起拜读一下大作吧~
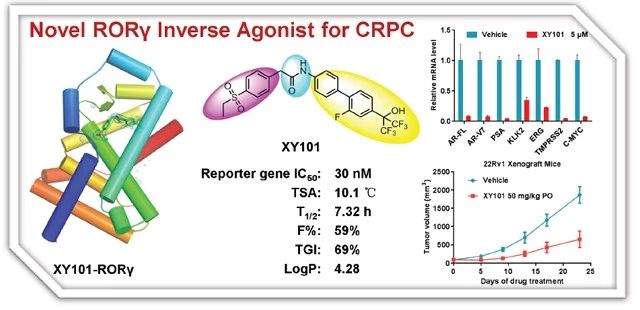
视黄酸受体-孤儿受体γ(RORγ),是核受体超家族中的一员,是一种配基依赖型的转录因子。RORγ 调节 Th17 免疫细胞产生促炎细胞因子白介素-17(IL-17;interleukin-17)和白介素-22(IL-22;interleukin-22)的功能。由于 RORγ 在多种重要炎症通路都发挥着相应的生物学功能。因此,现已开发了多种 RORγ 受体反向激动剂。
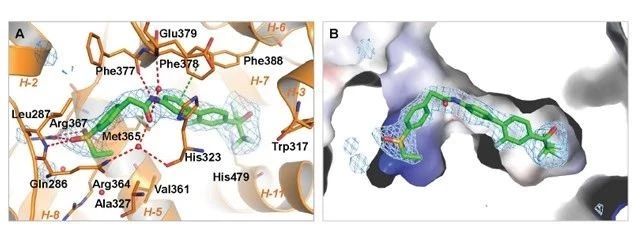
Zhang Y等,利用组合片段、替换基团的方式优化化合物结构,共合成了 36 种相关小分子化合物。在众多化合物中,发现了 XY101(化合物 27),能够显著的抑制 RORγ 的转录活性( IC50 = 30 nM),并对其他的核受体无明显抑制作用(如图2.所示)。
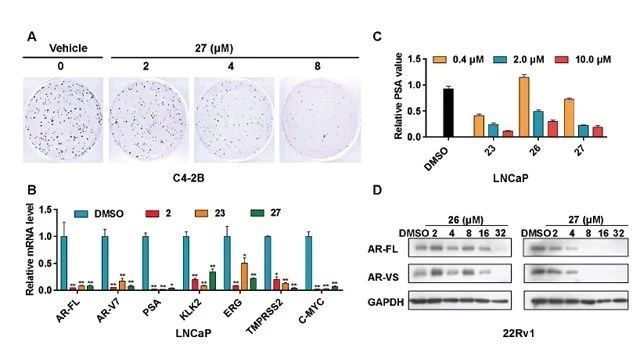
据体外细胞实验结果显示,化合物 XY101 可以抑制多种前列腺癌细胞的增殖与克隆形成,同时可有效抑制前列腺癌细胞中 AR、AR-v7 和 AR 调控的下游基因 PSA 等以及 ERG 和 MYC 等癌基因的表达(如图3.所示)。
随后,研究人员对化合物 27 的体内生物学效力进行了检测。在前列腺癌异种移植裸鼠(由 22Rv1 细胞诱导)模型中,以口服 XY101(10 mg/kg)和静脉注射 XY101(2 mg/kg)的方式给予小鼠处理。实验结果表明,XY101 对前列腺癌小鼠表现出良好的药效,能够显著抑制异种移植前列腺癌模型裸鼠中的肿瘤生长。研究人员还发现,XY101 具有优越的选择性、良好的代谢稳定性和体内生物利用度( T1/2= 7.32 h, F = 59%)(如图4.所示)。
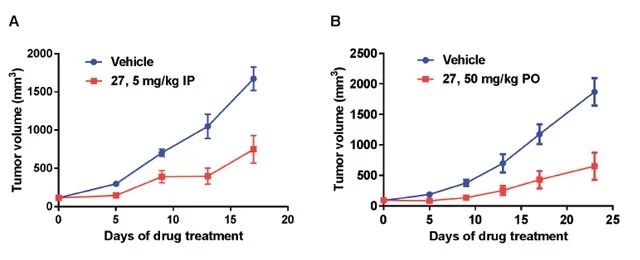

图1. 新型RORγ 反向激动剂—XY101
视黄酸受体-孤儿受体γ(RORγ),是核受体超家族中的一员,是一种配基依赖型的转录因子。RORγ 调节 Th17 免疫细胞产生促炎细胞因子白介素-17(IL-17;interleukin-17)和白介素-22(IL-22;interleukin-22)的功能。由于 RORγ 在多种重要炎症通路都发挥着相应的生物学功能。因此,现已开发了多种 RORγ 受体反向激动剂。
Zhang Y等,利用组合片段、替换基团的方式优化化合物结构,共合成了 36 种相关小分子化合物。在众多化合物中,发现了 XY101(化合物 27),能够显著的抑制 RORγ 的转录活性( IC50 = 30 nM),并对其他的核受体无明显抑制作用(如图2.所示)。

图2.RORγ 反向激动剂—XY101 结构图
据体外细胞实验结果显示,化合物 XY101 可以抑制多种前列腺癌细胞的增殖与克隆形成,同时可有效抑制前列腺癌细胞中 AR、AR-v7 和 AR 调控的下游基因 PSA 等以及 ERG 和 MYC 等癌基因的表达(如图3.所示)。

图3.XY101 体外细胞实验结果
随后,研究人员对化合物 27 的体内生物学效力进行了检测。在前列腺癌异种移植裸鼠(由 22Rv1 细胞诱导)模型中,以口服 XY101(10 mg/kg)和静脉注射 XY101(2 mg/kg)的方式给予小鼠处理。实验结果表明,XY101 对前列腺癌小鼠表现出良好的药效,能够显著抑制异种移植前列腺癌模型裸鼠中的肿瘤生长。研究人员还发现,XY101 具有优越的选择性、良好的代谢稳定性和体内生物利用度( T1/2= 7.32 h, F = 59%)(如图4.所示)。

图4.XY101 可明显抑制小鼠体内肿瘤的生长

 2019-04-23
2019-04-23 
 MCE小分子
MCE小分子

