肠道类器官培养基固定搭配还是DIY
3D 类器官,是过去十年中生物医学领域的革命性发展之一。前面推文中,我们已经给大家简单地介绍过类器官 (类器官——从 2D 到 3D 的进阶),作为类器官技术发展的重要里程碑——肠道类器官的建立,它的出现似乎充满了传奇的色彩
厚积薄发
类器官技术建立在干细胞技术以及经典发育生物学和细胞混合实验的基础之上;类器官的出现无疑是对干细胞研究不懈探索的惊喜回馈。
肠上皮是成年哺乳动物中自我更新最快的组织,自 2007 年,Hans Clevers 实验室就通过谱系追踪 (lineage tracing) 发现肠道 Wnt 靶基因中隐窝基底循环柱状细胞表达的 Lgr5 (leucine-rich-repeat-containing G-protein-coupled receptor 5, Gpr49) 可作为肠和结肠的干细胞的成体干细胞标志物,这也就是大名鼎鼎的 Lgr5+ 细胞。
2009 年,Hans Clevers 和 Toshiro Sato 用来源于小鼠肠道的成体干细胞培育出首个微型肠道 (Mini-guts) 类器官,开启了类器官技术的发展的“新纪元”。
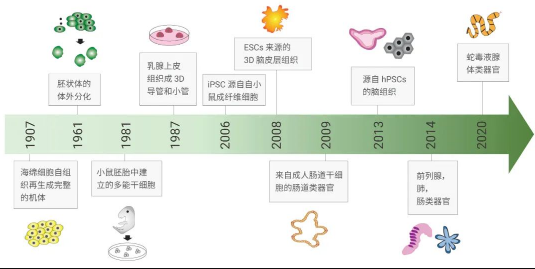
图 1. 类器官培养发展时间轴
肠道类器官技术已被广泛应用于多种领域,包括疾病建模、药物开发和筛选、宿主-微生物相互作用、肠道生物学与发育等
也有研究描述了将基因组编辑技术,如 CRISPR/Cas9 与类器官培养系统结合,使类器官易于基因操纵,并将其转化为一个多功能的培养系统。因此,肠类器官培养系统开启了小肠上皮体外建模的新时代,在个性化和再生医学中具有广阔的应用前景
肠道类器官的 “养成记”
3D 肠类器官由一个封闭的循环中空腔组成,内衬一层肠上皮细胞系。肠上皮的分化细胞系,包括肠上皮细胞,肠内分泌细胞和杯状 (Paneth) 细胞,排列在绒毛状区内。
肠类器官的发育类器官可来源于器官限制成体干细胞 (ASCs) 和多能干细胞 (PSCs) 两种干细胞。这两种干细胞来源产生的类器官包含体内发现的所有肠上皮细胞类型,比例和排列相似。
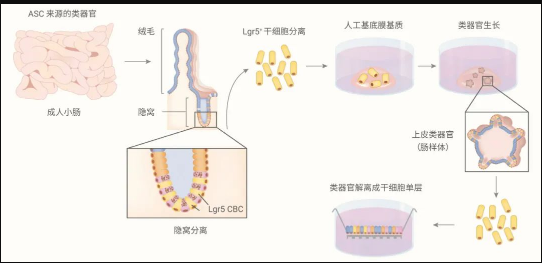
图 2. 体外培养 ASC 来源的肠类器官
培养类器官的主要成分是细胞外基质和培养基,培养基中添加促肠道发育的生长因子。其中,细胞外基质 (ECM) 为干细胞的粘附、生长和分化提供了必需的结构支持和生化诱因。类器官的形成和生长在很大程度上依赖于培养基成分,这些成分构成了十分接近体内干细胞生态位 (Niche) 的信号通路,以维持干细胞的功能,促进其扩展和分化为器官的特定细胞类型。
如果把肠道类器官培养当成是养成游戏,那么该怎么喂养呢,“定食” 还是“DIY 自助餐”?
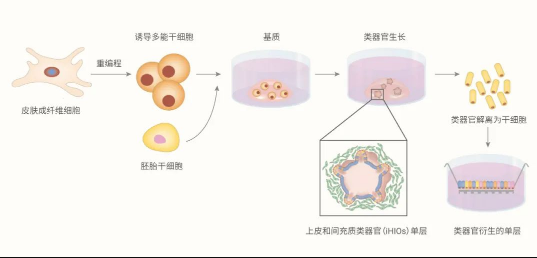
图 3. 体外培养 PSC 来源的肠类器官
■ 基础套餐来一套:
肠道类器官培养基的关键成分包括 Wnt-3a (W)、表皮生长因子 (EGF) (E)、Noggin (N) 和 R-spondin-1 (R),统称为 WENR 培养基。在培养基中有序地添加这些生长因子可调控干细胞生态位信号通路 (包括 Wnt、骨形态发生蛋白 (BMP) 和 Notch 信号通路),诱导肠道干细胞 (ISCs) 自我更新、增殖和分化。
■ “自助”更有它的妙:
也有一些研究表明,向 ENR 培养基 (包含 EGF + Noggin + R-spondin-1) 中加入其它成分,以诱导干细胞走向特定的分化命运图片。
例如,引入两种小分子的组合,如 CHIR99021 + Valproic acid 或者是 LDN-193189 + CHIR99021,可协同促进 Lgr5+ ISCs 在自我更新和未分化状态下的维持,得到富含 ISCs 的培养。
通过补充 DAPT + CHIR99021、Valproic acid + IWP-2 或 DAPT + IWP-2 的 ENR 培养基培养可获得分化表型,这些分子相互配合诱导 ISCs 直接分化为 Paneth 细胞 (杯状细胞) 及肠细胞和分泌细胞谱系 (肠内分泌细胞)。也有人认为,DAPT 或 BMP 分子的加入足以促进 ISC 分化并产生多谱系肠类器官。
虽然关于类器官培养基的组成有详细的综述,但不同方案的成分有时会存在差异,在培养技术中需要大量的试验和摸索,以确定剂量和时机,达到预期结果。
有说有练真把式,培养基 DIY!
2020 年 3 月,类器官“鼻祖” Hans Clevers 的团队再在 Science 上发表大作:SARS-CoV-2 productively infects human gut enterocytes,揭示了新型冠状病毒对人类肠道的有效感染。他们灵活运用肠道类器官的培养条件,将病毒对人类肠道的感染可视化。
hSIO (human small intestinal organoids; 人类小肠类器官) 由原代肠道上皮干细胞建立,通过符合伦理规范途径获得人类肠道组织样本。他们设定了四种不同培养(EXP、DIF、DIF-BMP、EEC)条件:
EXP:在 Wnt EXP (Expansion medium) 中生长的 hSIO 绝大多数由干细胞和肠细胞祖细胞组成,与 Wnt 条件培养基不同,培养基中添加 Wnt 替代物 (U-Protein Express)。
DIF:在 ENR 中实现了一般分化,称为 DIF (differentiation medium),在 DIF 培养基中生长的类器官含有肠细胞、杯状细胞和少量肠内分泌细胞 (EEC)。
DIF+BMP:通过从 ENR 中除去 Noggin 并添加 BMP-2/BMP-4 激活 BMP,导致进一步成熟。
EEC: 在 DIF + BMP 的条件下,用强力霉素 (Doxycycline) 在 ENR 培养基中稳定转染的载体中诱导 NeuroG3 的表达,以诱导 EEC 数量增加。
如图 3 所示,四种培养条件下生长的 hSIO 暴露于 SARS-CoV 和 SARS-CoV-2 2 种病毒。在所有培养条件下,两种病毒的传染性病毒颗粒和病毒 RNA 的滴度均显著增加。
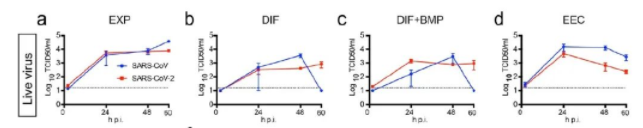
图 4:SARS-CoV 和 SARS-CoV-2 在 hSIO 中复制
SARS-CoV(蓝)SARS-CoV-2(红)感染后 24、48 和 60 小时,测定裂解的类器官活病毒滴度。
为了确定病毒目标细胞类型,对 hSIO 进行了共聚焦分析,不同的培养条件下共聚焦分析显示,SARS-CoV-2 的目标细胞为增殖的肠上皮细胞祖细胞 (EXP 条件下) 或有丝分裂后的肠细胞 (DIF 条件下),而肠内分泌细胞几乎没有感染。

图 5. SARS-CoV-2 感染 hSIO 的共聚焦分析
类器官肠上皮细胞刷状缘肌动蛋白通过 Phalloidin 标记 (绿色),DAPI 标记细胞核 (蓝色),病毒 dsRNA 染色显示感染细胞。A. 增殖的细胞在扩张的类器官中体现,Ki67 标记增殖细胞 (红色);B. 肠上皮细胞在分化的类器官中体现,APOA1 标记有丝分裂后的肠细胞 (红色)
看到这里,不得不称赞一句 Hans Clevers 类器官培养玩儿得真溜!绝绝子!
相关产品
Wnt3a
Wnt 参与调节细胞发育、增殖、分化、粘附、极性、细胞-细胞通信、生存和自我更新功能。Wnt3a 是类器官构建最常用的培养因子之一。
EGF
上皮组织生长因子 EGF 与其受体结合,诱导增生性变化。EGF 是胃肠道、肝脏、甲状腺、脑等类器官培养所需因子。
R-spondin-1
R-spondin-1 在干细胞的自我更新和 Wnt 信号的激活中发挥作用。它能诱导肠隐窝上皮细胞增殖,促进肠上皮愈合,支持肠上皮干细胞更新,是小鼠/人类器官祖干细胞维持和增殖的关键因子。
Noggin
Noggin 是骨形态发生蛋白的内源性抑制剂,调节细胞分化、增殖和凋亡。它是最基础的类器官培养因子之一。
BMP-2、BMP-4
BMP 在胚胎发生、发育和维持组织稳态中起着至关重要的作用。
CHIR-99021
选择性的 GSK3 抑制剂,可用于类器官的生成。CHIR99021+Valproic acid 或者是 CHIR99021+LDN-193189,可协同促进 Lgr5+ ISCs 在自我更新和未分化状态下的维持,得到富含 ISCs 的培养。
HDAC 的抑制剂;在类器官培养中,Valproic acid 和 CHIR99021 的组合可协同促进 Lgr5+ ISCs 在自我更新和未分化状态下的维持,得到富含 ISCs 的培养。
一种选择性的 BMP I 型受体抑制剂,抑制 ALK2 和 ALK3 的 IC50 分别为 5 nM 和 30 nM。
IWP-2
Wnt 加工和分泌的抑制剂,其 IC50 为 27 nM。
DAPT
可抑制 Notch 1 信号传导并诱导细胞分化。

 2022-03-04
2022-03-04 
 MCE小分子
MCE小分子

