内质网应激-未折叠蛋白反应
内质网是个很聪明的细胞器,当内质网中任何生命活动反应发生异常时,内质网会引发一系列保护机制——内质网应激 (ERS),从而保障内质网的稳态。其中,最典型的就是未折叠蛋白反应。
真核细胞的内质网 (Endoplasmic Reticulum, ER) 是一个独立的代谢腔室,是真核细胞内蛋白合成、脂质生成和钙离子贮存的主要场所。ER 是分泌蛋白折叠、多种蛋白翻译后修饰、如糖基化和二硫键形成的重要位点。ER 的稳态调控能够保障正确折叠的蛋白进行下一步的修饰,而缓慢折叠或不折叠的蛋白会被保留在内质网中,并通过内质网相关蛋白降解 (Endoplasmic-reticulum-associated protein degradation, ERAD) 进行蛋白酶体降解,这就是未折叠蛋白反应 (Unfolded Protein Response, UPR)。
那么,蛋白折叠到底是如何发生,未折叠蛋白又是如何被感知、如何通过内质网膜传导从而引发细胞和机体对内质网应激的反应的呢?
蛋白是如何正确折叠的
疏水效应是 ER 中蛋白折叠的主要驱动力。所有新生肽链通过 Sec61p 转位通道以未折叠、完全展开的构象进入内质网。新生肽链在内质网中的翻译后修饰,如 N-连接糖基化和二硫键的形成,使蛋白质在内质网中的折叠比在胞质中更复杂。亲水 N-连接寡聚糖附着在蛋白表面,保护附着位点附近不与其他蛋白质的疏水作用相互影响,使蛋白折叠反应具有不可逆性。ER 蛋白折叠机制不仅能够正确地识别折叠合格蛋白,还能够识别缓慢折叠或不折叠的多肽链,并针对这些 "不合格品" 进行蛋白降解。
ER 包含至少三种蛋白折叠机制,第一种,HSP70 分子伴侣 BiP/GRP78/Kar2p 和 Lhs1p/GRP170/ORP150;第二种,HSP90 分子伴侣 GRP94;第三种,凝集素分子伴侣钙联接蛋白、钙网蛋白和钙镁蛋白。
一个完全展开的新生肽链通过 Sec61p 转位通道进入内质网进行进一步的翻译、修饰,并参与 BIP. ATP、BIP. ADP 循环,从而促进易位反应并协助多肽链的初始折叠。部分折叠的蛋白转移到 HSP90 伴侣蛋白 GRP94上,进一步折叠。钙联接蛋白周期中消耗大量 UDP-D-葡萄糖和大量 ATP。蛋白质二硫键异构酶 (PDI) 和伴侣分子也助蛋白折叠一臂之力。当该蛋白被 ER 常驻伴侣蛋白系统识别为 "合格品" 时,则顺利从 ER 输出,否则便引发 UPR。
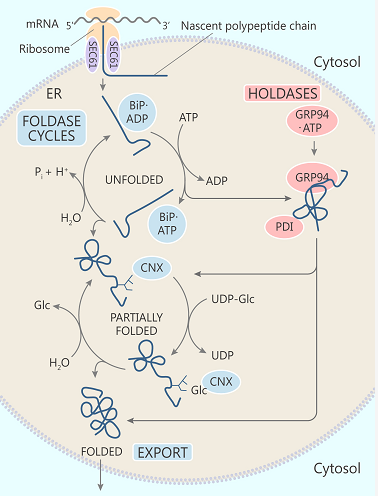
哺乳动物内质网 (ER) 中一般蛋白的折叠系统
三种 UPR 信号转导时刻监控未折叠蛋白
当未折叠蛋白在内质网中累积时,ER 常驻蛋白伴侣被占据,释放参与诱导 UPR 的 ER 跨膜蛋白。这些跨膜蛋白,其 N 端在 ER 腔内,C 端在胞质中,搭成了一个连接内质网和胞质的桥梁。通常来说,这些 ER 跨膜蛋白的 N 端由 ER 伴侣蛋白 Grp78 (BiP) 调控,组织其聚集。但当未折叠蛋白在 ER 中累积时,Grp78 释放,使这些跨膜信号蛋白聚集,感应并传递 UPR 信号。PERK、IRE1 和 ATF6 是 ERS 三条信号通路的重要分子。
PERK (Protein kinase R (PKR)-Like Endoplasmic Reticulum Kinase) 是一种 Ser/Thr (丝氨酸/苏氨酸) 蛋白激酶, 其催化结构域与其它真核起始因子 2α (eIF2α) 家族的激酶具有高度同源性。Grp78 一旦释放,PERK 开始在 ER 膜内低聚激活,诱导其自磷酸化并激活激酶结构域。PERK 磷酸化 eIF2α,使其处于未激活状态,从而大面积的阻断下游 mRNA 的翻译,降低 ER 的蛋白负荷。但是,eIF2 受到限制时,一些 5’ 端含有短开放阅读框 (OPF) 的 mRNA 开始翻译,比如 ATF4。ATF4 驱动两个重要靶基因 CHOP (transcription factorC/EBP homologous protein) 和 GADD34 (growth arrest and DNA damage–inducible 34)。CHOP 是一种转录因子,控制细胞凋亡相关基因的编码。如此说来,PERK 不仅降低 ERS 中的蛋白负荷,同时也为细胞死亡通路提供信号。GADD34 编码了蛋白磷酸酶 PP1C 的一个亚基,该亚基通过去磷酸化 eIF2a 来抵消 PERK 作用。选择性的抑制 GADD34 或 GADD34- PP1c 复合体时,可以通过延长低水平的 eIF2α 磷酸化来保护细胞不受 ERS 的影响。而当 GADD34 受损时,组成型 eIF2α 磷酸酶 CReP 的缺失会导致致命的后果,从而强调了这种平衡调节 eIF2α 去磷酸化的重要性。
Grp78 释放的时候,IRE1 (Inositol-requiring enzyme 1) 也会低聚激活。Ire1α 也是一种跨膜蛋白,是一种双功能跨膜激酶/核糖核酸内切酶,利用独特的、非常规 mRNA 剪接机制来传递 UPR 信号。UPR 时, 激活的核酸内切酶 IRE1α 能从 X 盒结合蛋白 1 (XBP-1) mRNA 中特异性剪切 26 个碱基的内含子,改变 XBP-1 mRNA 的开放阅读框,其翻译产物 XBP-1 能促进含内质网应激反应元件的未折叠蛋白反应靶分子如 GRP78 表达,以减轻或中止内质网应激反应,恢复细胞内稳态。不仅如此,XBP-1 似乎在调节脂质生物合成酶和与 ER 相关的降解成分方面也有重要作用。
与 PERK、IRE1 相比, Grp78 的释放触发了 ATF6 (Activating transcription factor 6) 不同的蛋白激活机制。说起 ATF6,不得不提起它的特殊结构,ATF6 是一个单通道的、2 型跨膜蛋白,其 N 末端为 “胞质” 结构域。N 末端的 370-380 个氨基酸组成的结构域是 bZip (basic-leucine zipper) 转录因子。接着是一个 21 个氨基酸的跨膜结构域和一个 270 个氨基酸的胞质结构域并跨膜投射到内质网腔。当未折叠蛋白在 ER 中积累时,释放的 Grp78 使 ATF6 转移到高尔基体,在高尔基体近膜位点上常驻蛋白酶(site 1 和 site 2 蛋白酶)裂解 ATF6,ATF6 蛋白水解释放 N-末端结构域,进入细胞核。它激活至多个伴侣分子 (PDI,GRP78、GRP94 和钙联接蛋白) 的转录,ATF6 还能诱导 XBP-1 转录,协同 Ire1,Ire1 经核内切核糖核酸酶,产生 XBP-1 蛋白。XBP1 转录因子,可作为内质网应激反应时的传感器。
总的来说,ATF6 很大程度上增加了 ER 中的蛋白折叠能力,而 PERK 和 IRE1 分别通过下调翻译和降解 ER 结合的 mRNA 来降低 ER 的折叠负荷。
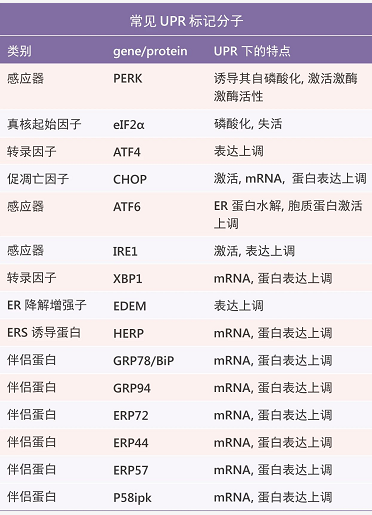
UPR 常见标记分子不完全统计
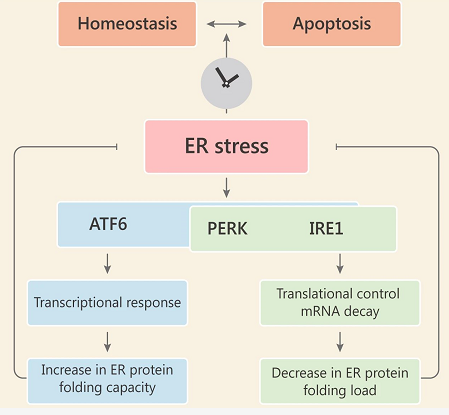
内质网应激感应模型概览
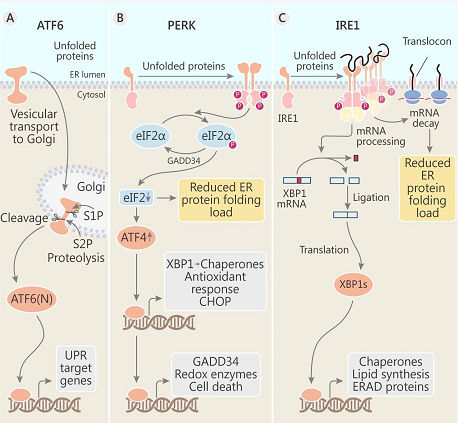

三种 UPR 信号转导机制
ERAD 和自噬降解未折叠蛋白
内质网应激可以正确识别获取折叠缓慢或者不完全折叠的蛋白,并引发蛋白降解程序。常见的两种降解途径有:第一种,未折叠多肽链的逆转异位进入胞质,随后引发泛素化和蛋白酶体降解,这一过程被称为 ERAD;第二种,内质网的一部分靶向至溶酶体或者液泡引发自噬。详情请见下回分解。
不要走开,下期还有ERS相关产品大盘点哦。
结语:UPR 过程复杂,多种机制发挥作用,细胞小心地平衡,以保护自己免受毒性,维持稳态。尽管在这一领域已经取得了巨大的进展,但仍有许多问题没有解释清楚。UPR 与多种人类疾病息息相关,如癌症、炎症、神经退行性疾病、糖尿病等,使得 UPR 信号成为治疗干预的一个潜在靶标。UPR 在细胞的整个生命周期中都起着重要的作用,而 ERS 中的 UPR 才窥见一斑,研究数十年,仍然有很多未知,而靶向药物的开发,更是任重而道远。

 2020-04-11
2020-04-11 
 MCE小分子
MCE小分子

