NF-κB 信号通路
紫外线辐射、DNA 损伤、和活性氧等多种刺激都已被证明会导致 NF-κB 活化。NF-κB 亚基的激活导致它们的核易位和转录激活;NF-κB 通路可调节许多基因的转录,包括促炎细胞因子和趋化因子 (如 IL-6)、细胞周期基因 (如 cyclin D1)、抗凋亡基因 (如 bcl-2)和胞外蛋白酶 (如 MMP3)等。
本文小 M 带大家了解老生常谈的 NF-κB 信号通路。
NF-κB 大家族
哺乳动物 NF-κB 家族由五种成员组成:RelA/p65、c-Rel、RelB、p50 (NF-κB1) 和 p52 (NF-κB2),它们可以形成各种异源二聚体或者同源二聚体 (如常见 p50/RelA 异源二聚体),并通过与启动子的 κB 位点结合来激活大量基因。
所有 NF-κB 亚基都包含一个保守的 Rel 同源域 (RHD),可促进二聚化和 DNA 结合。RelA/p65、c-Rel 和 RelB 亚基还包含一个反式激活域 (TAs),对转录活性至关重要 (如图 1A)。p50 和 p52 亚基不包含 TAs,在同源二聚体形式中主要充当转录阻遏物 (与反式激活 Rel 亚基异二聚化时可以刺激转录)。
细胞质中含有的 IκB 蛋白会抑制 NF-κB 蛋白。当前已鉴定出的主要 IκB 家族成员:IκBα、IκBβ、Bcl-3、IκBε 以及前体蛋白 p100 和 p105 (如图 1B)。前面说到的 p50 和 p52 亚基有一个共同点,即它们都是由前体蛋白 p105 和 p100 的蛋白水解加工产生的。
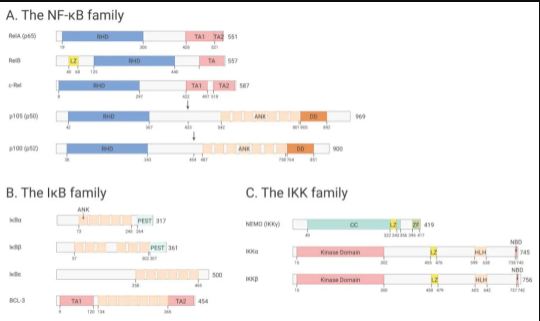
图 1. NF-κB 信号通路和 IκB 激酶复合物的成员
经典 VS. 非经典 NF-κB 信号通路
NF-κB 激活通过两个主要信号通路发生:经典和非经典 NF-κB 信号通路,两种通路具有不同的激活机制。
■ 经典 NF-κB 通路
在暴露于促炎信号后数分钟内被激活。它由含有 NEMO (也称为 IKKγ,NF-κB 信号必需调节剂) 的 IKK 复合物的激活介导,后者又指定经典的 IκB 进行降解,随后释放 NF-κB 二聚体用于核易位。(注:IKK 复合物包括三个重要的成员,NEMO,IKKα,IKKβ)。
■ 非经典 NF-κB 通路
由特定的受体激活,如 TNF 受体超家族成员,由独立于 NEMO 的 NIK (NF-κB 诱导激酶) 介导。另外,通过突变或 NEMO 缺失来抑制经典 NF-κB 激活会增加 NIK 积累,并产生异常的非经典 NF-κB 信号。
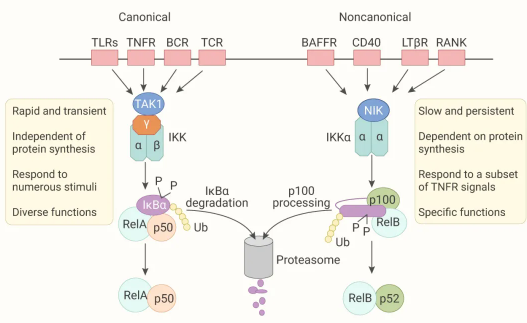
图 2. 经典和非经典 NF-κB 信号通路
左:经典途径由许多信号触发,涉及 TAK1 激活 IKK 复合物、IKK 介导 IκBα 磷酸化和随后的降解,导致 NF-κB 异二聚体 RelA/p50 的瞬时核易位;右:非经典 NF-κB 通路,依赖于 NIK 和 IKKα,并介导 RelB/p52 复合物的持续激活。
■ 经典的 NF-κB 通路激活
经典的 NF-κB 通路可以被各种刺激物激活,如 TNFα,LPS,IL-1β 等,并通过细胞表面受体,如 IL-1R、TLR,TNFR 以及抗原受体介导,通过各种衔接蛋白和信号激酶 IKK 激活复合物。
如下图 4: TNFR1 与在 TNF-α 结合后,形成三聚体,并促进接头蛋白 TRADD 和 RIP1 的募集。TRADD 招募 TRAF2/5,后者又招募泛素连接酶 cIAP1 和 cIAP2。cIAP1/2 蛋白促进自身泛素化以及其他下游信号蛋白的泛素化。图片这些 cIAP 生成的多泛素化 (polyUb) 链用作 LUBAC 以及 TAK/TAB 和 NEMO/IKK 复合物的招募平台,并线性泛素化 NEMO,促进 IKK 复合物的招募和活化。
IKK 复合物的活化导致 NF-κB 抑制剂蛋白 IκBα 的磷酸化,最终导致其蛋白酶体降解,并使 NF-κB 二聚体,如 p50-RelA (p65) 释放并易位至细胞核驱动靶基因的转录。
在许多情况下,NF-κB 二聚体激活靶基因需要其他转录因子的协助,包括 STAT、AP1 家族成员,p53,NRF2,IRFs 等。

图 3. TNFR1 介导的 NF-kB 激活
■ 非经典 NF-κB 激活
受到特定 TNF 受体家族成员的刺激 (包括:LTβR,CD40,CD27,CD30,BAFF-R,RANK 等),这些成员通过募集 TRAF2 和 TRAF3 发出信号。
非经典途径中的上游激酶是 NF-κB 诱导激酶 (NIK)。如前面的图 2,pIKKα 对 p100 的磷酸化至关重要,导致蛋白体加工成 p52,产生激活的 p52/RelB 复合物,它能够转移到细胞核并诱导下游基因表达。
NF-κB 通路与炎症、免疫和癌症
■ NF-κB 与肿瘤微环境
其实小 M 在之前的靶向肿瘤微环境中提过 NF-κB。肿瘤微环境有许多细胞成分,包括肿瘤相关巨噬细胞 (TAM)、树突细胞 (DC)、髓源性抑制细胞 (MDSC)、中性粒细胞、肥大细胞、自然杀伤 (NK) 细胞等。NF-κB 在所有这些细胞类型中起作用并调节炎症、肿瘤发生和转移的作用。
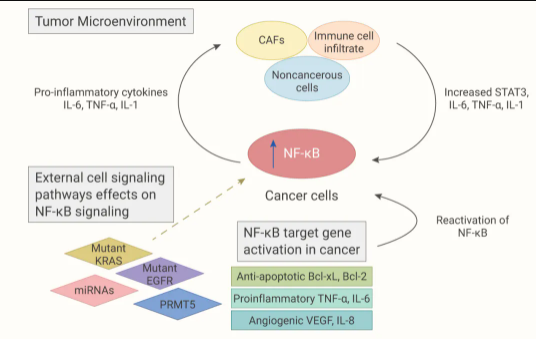
图 4. 肿瘤中 NF-κB 信号通路与肿瘤微环境 (TME) 之间的相互作用
■ NF-κB 与自噬
自噬是一种自我消化系统,可处理细胞碎片以维持细胞稳态和健康。NF-κB 和自噬错综复杂地调节彼此。例如,NF-κB 诱导表达 BECN1,SQSTM1 和其它自噬相关蛋白以增强自噬,而自噬降解 IKK 亚基和抑制 NF-κB 信号。
除此之外,NF-κB 和细胞衰老,组织再生和修复,癌症干细胞以及细胞代谢都有十分密切的关系。
■ NF-κB 作为癌症治疗的靶点
NF-κB 信号通路在大多数癌症的发展和进展中发挥重要作用。
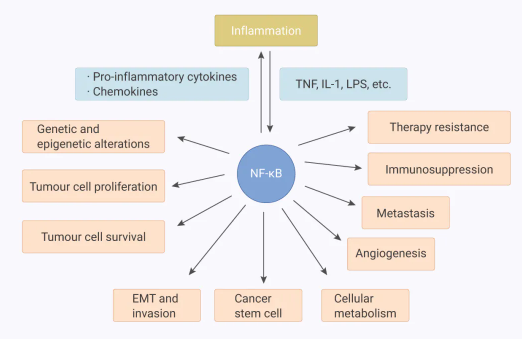
图 5. NF-κB、炎症、免疫和癌症
NF-κB 长期以来被认为是治疗疾病的潜在靶点。一些抗炎药如阿司匹林 (Aspirin)、水杨酸钠 (Sodium Salicylate) 和地塞米松 (Dexamethasone) 已被证明可以抑制 NF-κB 的活化。如阿司匹林和水杨酸钠通过阻断 IκBα 的降解来抑制 NF-κB。除了抑制 NF-κB 通路的关键成分外,另一种选择是阻断其下游目标或上游刺激物。例如,TNF-α 是 NF-κB 通路的激活剂和效应子,而 FDA 批准的抗 TNF-α 抗体英夫利昔单抗 (Infliximab) 在晚期癌症研究中表现出良好的耐受性。
■ NF-κB 抑制剂与其他的联合使用
与 NF-κB 抑制剂和常规疗法如化疗和放疗联合使用可能更有效。此外,临床治疗可以利用 NF-κB 抑制剂和其他炎症相关信号的抑制剂,如 AP1 和 STAT3,为某些癌症开发有效和特异性的治疗方法。
小结
经典的 NF-κB 在免疫反应中起着至关重要的作用,但长期使用 NF-κB 抑制剂会导致免疫缺陷,因此应在短时间内使用 NF-κB 抑制剂治疗癌症。此外,理想的 NF-κB 抑制剂应该特异性靶向 NF-κB 通路而不影响其他信号通路。
此外,我们需要做更多的工作来阐明经典和非经典 NF-κB 如何驱动肿瘤发生,并确定它们是否可以被有效地靶向。NF-κB 抑制剂在癌症治疗中的应用还有很长的路要走。
NF-κB 相关抑制剂
可逆性和选择性的蛋白酶体 (proteasome) 抑制剂,通过靶向苏氨酸残基有效抑制 20S 蛋白酶体 (Ki=0.6 nM)。破坏细胞周期、诱导细胞凋亡以及抑制核因子 NF-κB。
Aspirin
抗炎类药物,阻断 IκBα 的降解来抑制 NF-κB。
Sodium Salicylate
抗炎类药物,阻断 IκBα 的磷酸化和降解,抑制 NF-κB。
Sulfasalazine
NF-κB 经典抑制剂。可直接抑制 IKKα 和 IKKβ。
糖皮质激素受体 (glucocorticoid receptor) 激动剂。抑制 NF-κB 的活化。
BMS-345541 hydrochloride
选择性的 IKK 催化亚基 IKK-1 (IKK-α) 和 IKK-2 (IKK-β) 抑制剂,抑制 IKK-2 和 IKK-1,IC50 值分别为 0.3 μM 和 4 μM。
BAY 11-7082
IκBα 磷酸化和 NF-κB 抑制剂,选择性且不可逆地抑制 TNF-α 诱导的 IκB-α 磷酸化,并减少 NF-κB 和粘附分子的表达。
Curcumin
天然酚类化合物,是 NF-κB 抑制剂。
Resveratrol
天然多酚类化合物,具有抗氧化,抗炎,保护心脏和抗癌的特性。靶点广泛,如 mTOR、JAK、β-amyloid、Adenylyl cyclase、IKKβ、DNA polymerase。
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。

 2021-12-06
2021-12-06 
 MCE小分子
MCE小分子

