不可成药靶点 KRAS: 关门才是大吉
当 “不可成药靶点” 的标签被撕下,KRAS 将给我们带来无限可能。
RAS 基因 (HRAS, KRAS 和 NRAS) 是人类癌症中最常见的突变癌基因家族。这三种 RAS 基因编码 4 种不同的 RAS 蛋白: HRas,NRas 和剪接变体 KRas4A、KRas4B,它们都属于小 GTP 酶的蛋白质家族。而在所有 RAS 驱动的癌症中,约有 85% 是 KRAS 突变,不仅存在于胰腺癌,结肠癌和肺癌中,也存在于胆道恶性肿瘤,子宫内膜癌,宫颈癌,膀胱癌,肝癌,髓细胞性白血病和乳腺癌中。其中 KRAS G12D,G12V 和 G12C,尤其是 G12C 突变,是非小细胞肺癌 (NSCLC)、结肠癌和胰腺癌的主要突变亚型。
KRAS 蛋白通过结合 GTP 和鸟苷二磷酸 (GDP),在活性和非活性形式之间切换。此过程受到鸟嘌呤核苷酸交换因子 (GEFs, 如 SOS) 和 GTPase 活化蛋白 (GAPs) 的调控,GEFs 通过刺激 GDP 交换为 GTP,KRAS 处于激活状态; GTPase 活化蛋白 (GAPs) 通过刺激 GTP 水解而终止活性状态。在 KARS 激活状态下,会涉及两个区域的构象变化 (Switch I 和 II),这种构象变化使 KRAS 与下游效应子相互作用,并导致一系列下游信号传递事件。
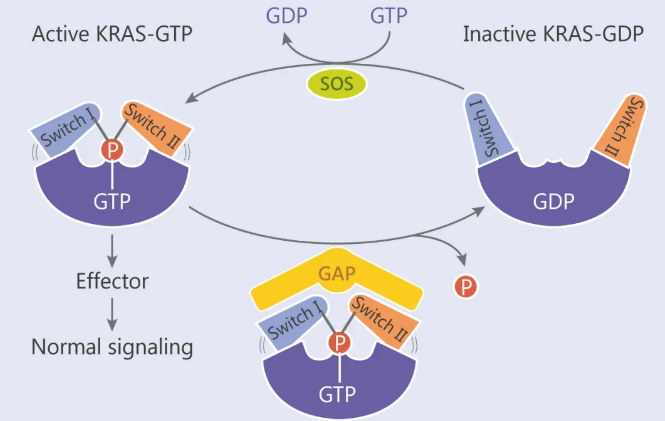
KRAS-GDP 与 KRAS-GTP 循环图
而突变的 KRAS 会通过破坏 GAP 活性,将 KRAS 锁定在活跃状态,并与下游效应子结合,最终促成肿瘤发生。该发生过程可能激活了多种信号传导途径,如 PI3K,RAF-MEK-ERK (MAPK),RAL-GEF 等。另外,致癌性 KRAS 还以旁分泌方式诱导影响基质周围的细胞 (如成纤维细胞,先天性和适应性免疫细胞),这些基质细胞反过来又促进了癌症的恶性。
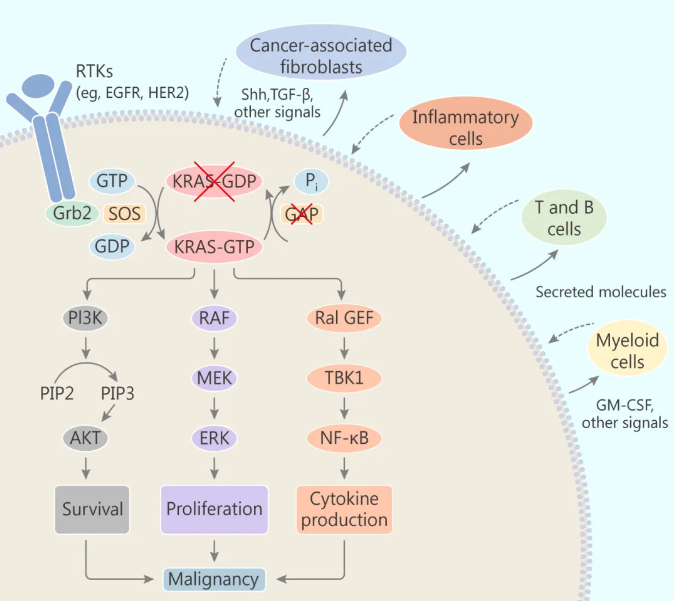
KRAS 突变体主要的效应途径
尽管直接靶向 KRAS 具有临床意义,但之前由于 KRAS 蛋白表面缺乏合适的结合口袋,而 KRAS 对 GTP 有极高的亲和力,以及细胞质中 GTP 的浓度较高等因素,导致近三十年,KRAS 都被钉在了 “不可成药靶点” 的柱子上。
就在 2013 年,Shokat 首次报道了利用小分子共价结合 KRAS G12C 突变体的可行性。这是由于突变型半胱氨酸 KRAS G12C 产生了一个易于靶向的狭窄口袋 (Switch II Pocket)。研究人员认为它相邻的组氨酸 95 (H95) 残基可能提供稳定药物-蛋白质相互作用的位点。通过结合此口袋和 H95,共价抑制剂可将 KRAS G12C 锁定在非活性状态,从而阻断致癌信号,而不会破坏未突变KRAS的正常功能。
![靶向 KRAS[1]](/uploads/allimg/200326/1-200326144932a3.png)
靶向 KRAS[1]
2019 年 10 月,《自然》杂志上公开报道了临床开发中的第一例共价 KRAS G12C 抑制剂——AMG 510。AMG 510 一出场就成了焦点。它不可逆的与 KRAS G12C 突变中的半胱氨酸残基结合,将 KRAS G12C 锁定在非活跃的 GDP 约束状态。
在临床前分析中,AMG 510 选择性靶向 KRAS G12C 肿瘤并引起肿瘤持久的消退,且与其他靶向药物的 “组合” 使用 (如 HER 激酶, EGFR, SHP2, MEK 抑制剂 ),可提高抗肿瘤功效。同时,AMG 510 也与抗 PD-1 治疗起协同作用。去年在美国临床肿瘤学会 (ASCO) 上公布的首个临床数据表明,AMG 510 对 NSCLC 客观缓解率 (ORR) 达 50%,并且毒副作用低。
但作为 KRAS G12C 抑制剂的 AMG 510 并非 “高处不胜寒”,MRTX849,ARS-1620,ARS-853 等 KRAS G12C 抑制剂也纷至沓来。MRTX849 以纳摩尔 (nM) 水平抑制 KRAS G12C,作用机理与 AMG 510 类似,通过结合在KRAS G12C产生的Switch II的口袋,将蛋白锁定在非活性的 GDP 结合构象。同样,MRTX849 目前也已经处于临床期。ARS-1620 是一种阻转异构选择性 KRASG12C 抑制剂,具有理想的药代动力学特性。可快速持续靶向 KRAS G12C,诱导肿瘤消退。ARS-853 作为 KRAS G12C 共价抑制剂,则是通过靶向 GDP 结合的非活性状态,阻止形成 GTP 结合的活跃状态,导致活跃 KRAS G12C 水平和下游信号降低。
除了上述直接靶向 KRAS 外,还可以通过抑制鸟嘌呤核苷酸交换因子 SOS1 (可激活 KRAS) 的间接方式,抑制 KRAS 的激活。另外,还有一款基于 KRAS 蛋白的 Switch I/II 口袋的抑制剂 BI-2852,也被认为是未来的希望。它可通过阻断 GEF, GAP 和效应子与 KRAS 的相互作用,使下游信号传导的抑制。
抑制剂作用机制
一种具有口服生物可利用的,突变选择性的 KRAS G12C 共价抑制剂;可将 KRAS G12C 锁定在非活跃的 GDP 约束状态;能使 KRAS G12C 肿瘤消退; Phase 3
MRTX849
一种具有口服活性的,突变选择性的 KRAS G12C 共价抑制剂;在半胱氨酸 12 残基处与 KRAS G12C 共价结合,将蛋白锁定在非活性的 GDP 结合构象中,并抑制 KRAS 依赖性信号转导;具有抗肿瘤活性; Phase 1/2
ARS-1620
一种阻转异构且有选择性的 KRAS G12C 抑制剂,具有理想的药代动力学
ARS-853
一种选择性,共价的 KRAS G12C 抑制剂,IC50 为 2.5 μM;通过与 GDP 结合的癌蛋白结合并阻止激活来抑制突变 KRAS 驱动的信号传导
BI-2852
基于药物结构设计的 switch SI/II 口袋的 KRAS 抑制剂;阻断 GEF,GAP 和效应子与 KRAS 的相互作用,导致下游信号传导的抑制和 KRAS 突变细胞中的抗增殖作用
总结:
尽管针对 KRAS 突变体 (如 G12C) 药物尚未上市,但这个新的方向给 KRAS 领域带来了希望。相信随着 KRAS 靶向药物的进展,以及 KRAS 新口袋的发现,将有助于更快征服致癌性 KRAS。

 2020-03-27
2020-03-27 
 MCE小分子
MCE小分子
